Si vous êtes d’ascendance africaine, vous pourriez porter une variation génétique qui augmente votre risque de développer une maladie rénale grave - même si vous vous sentez en parfaite santé. Ce n’est pas une question de race, mais de génétique ancestrale. Et cette découverte change tout ce qu’on pensait savoir sur les inégalités dans les maladies rénales.
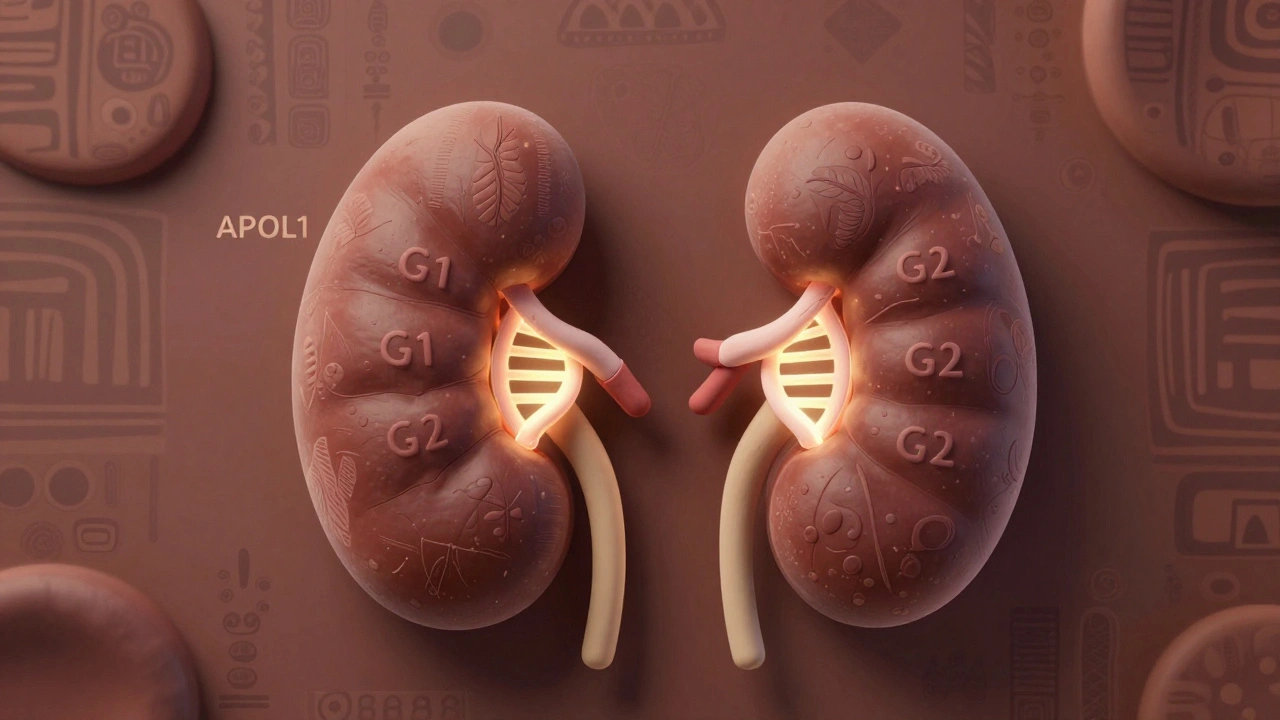
Qu’est-ce que le gène APOL1 ?
Le gène APOL1 code pour une protéine qui fait partie de votre système immunitaire. Chez les personnes d’origine ou d’ascendance africaine, certaines variantes de ce gène - appelées G1 et G2 - ont évolué il y a des milliers d’années pour protéger contre le parasite responsable du sommeil africain, une maladie mortelle transmise par la mouche tsé-tsé. Ces variantes ont été sélectionnées naturellement parce qu’elles permettaient de survivre plus longtemps dans les régions où cette maladie était courante.
Mais il y a un revers à cette protection. Ces mêmes variantes, quand elles sont présentes en deux copies (une de chaque parent), deviennent toxiques pour les cellules rénales. Cela augmente considérablement le risque de développer des formes sévères de maladie rénale, comme la focal segmental glomerulosclérose (FSGS), la néphropathie hypertensive ou la glomérulopathie effondrée, souvent liée au VIH.
Combien de personnes sont concernées ?
Environ 13 % des Afro-Américains aux États-Unis portent deux copies de ces variantes à risque - ce qu’on appelle un génotype à haut risque. Chez les personnes d’ascendance africaine atteintes d’une maladie rénale non diabétique, ce chiffre grimpe à près de 50 %. Cela signifie que près de la moitié des cas de défaillance rénale chez ces populations ne sont pas causés par le diabète ou l’hypertension, mais par cette variation génétique.
Les données sont similaires dans d’autres pays : au Royaume-Uni, environ 49 % des cas d’insuffisance rénale terminale chez les personnes noires infectées par le VIH sont directement attribuables à APOL1. En Afrique de l’Ouest, jusqu’à 30 % des personnes dans certaines régions comme le Ghana ou le Nigeria portent ces variantes. Ce n’est pas une question de couleur de peau - c’est une question d’origine génétique. Ces variantes sont quasiment absentes chez les populations d’origine européenne, asiatique ou autochtone américaine.
Une maladie qui ne touche pas tout le monde
Voici le point le plus important : avoir un génotype à haut risque ne signifie pas que vous allez développer une maladie rénale. En fait, environ 80 à 85 % des personnes avec ces variantes gardent une fonction rénale normale toute leur vie. Seulement 15 à 20 % développent une maladie rénale. Pourquoi ? Parce que le gène APOL1 a besoin d’un « second coup » pour déclencher la maladie.
Ces « seconds coups » peuvent être : une infection virale comme le VIH, une hypertension mal contrôlée, une obésité, un traitement médicamenteux toxique pour les reins, ou même un stress chronique. C’est comme avoir une bombe à retardement dans votre corps - mais elle ne peut exploser que si certaines conditions sont réunies.
C’est aussi ce qui rend APOL1 si unique. La plupart des maladies génétiques rénales, comme la maladie polykystique rénale, se manifestent chez presque tous les porteurs. APOL1, lui, est une maladie à pénétrance incomplète. Cela rend les conseils médicaux plus complexes - et plus nécessaires.

Comment savoir si vous êtes à risque ?
Un test génétique simple peut déterminer si vous portez les variantes G1 ou G2. Il suffit d’un prélèvement de salive ou de sang. Ce test est disponible depuis 2016 et coûte entre 250 et 450 dollars sans assurance. Il est particulièrement recommandé pour :
- Les personnes d’ascendance africaine avec une maladie rénale non diabétique
- Les personnes qui envisagent de devenir donneur de rein
- Les personnes ayant un antécédent familial de défaillance rénale
Le National Institutes of Health (NIH) recommande désormais que tous les donneurs vivants d’origine africaine soient testés avant la donation. C’est une mesure de sécurité : une personne avec un génotype à haut risque ne devrait pas donner un rein, car elle pourrait développer une maladie rénale plus tard.
Malheureusement, une étude de 2022 a montré que 78 % des néphrologues aux États-Unis se sentent mal formés pour expliquer ces résultats à leurs patients. Beaucoup pensent encore que « si vous êtes noir, vous avez plus de risques » - sans comprendre que c’est une question de génétique, pas de race.
Les conséquences d’un diagnostic
Une femme nommée Emani, citée par la Kidney Fund en 2023, a appris qu’elle avait un génotype à haut risque avant d’avoir des lésions rénales. Grâce à ce savoir, elle a commencé à surveiller sa pression artérielle, à éviter les anti-inflammatoires, à perdre du poids et à faire un test d’albumine dans les urines chaque année. Cinq ans plus tard, ses reins fonctionnent toujours normalement.
En revanche, un utilisateur sur le forum de la National Kidney Foundation a écrit : « Mon médecin m’a dit que j’avais 1 chance sur 5 de développer une maladie rénale. L’incertitude est plus stressante qu’un diagnostic certain. »
Beaucoup de patients rapportent avoir été ignorés ou mal diagnostiqués avant leur test génétique. « On m’a dit que c’était juste de l’hypertension », raconte un homme de 42 ans sur Reddit. « J’ai perdu 60 % de ma fonction rénale en 3 ans avant qu’on pense à faire un test APOL1. »
Que faire si vous êtes à risque ?
Si vous avez un génotype à haut risque, voici ce que vous pouvez faire maintenant :
- Surveillez votre pression artérielle : cible à moins de 130/80 mmHg. Utilisez un appareil à domicile et tenez un journal.
- Faites un test d’albumine dans les urines chaque année : c’est le premier signe de lésion rénale.
- Évitez les médicaments toxiques : les AINS comme l’ibuprofène, certains antibiotiques et les produits à base de bismuth peuvent endommager les reins.
- Maintenez un poids santé : l’obésité aggrave le stress sur les reins.
- Contrôlez le VIH et d’autres infections : si vous êtes séropositif, un traitement antirétroviral efficace réduit le risque de néphropathie.
Il n’y a pas de traitement spécifique pour APOL1 encore - mais cela va changer. En octobre 2023, une molécule appelée VX-147, développée par Vertex Pharmaceuticals, a montré une réduction de 37 % de la protéinurie en seulement 13 semaines dans un essai clinique. Ce pourrait être le premier traitement ciblé contre la maladie rénale APOL1.

Un problème mondial
Le problème, c’est que ce test et ces traitements sont presque inaccessibles dans les pays à revenu faible ou intermédiaire. Seuls 12 % des pays à faible revenu ont la capacité de faire un test APOL1. Pourtant, ce sont aussi les régions où les variantes sont les plus fréquentes - en Afrique de l’Ouest, en Afrique centrale, dans les Caraïbes.
Le projet Global Kidney Health Atlas de 2023 appelle cela une « injustice en santé » : une découverte scientifique majeure, qui pourrait sauver des vies, est bloquée par des inégalités économiques et géographiques.
Et les médecins ?
Les directives de la Société Américaine de Néphrologie, mises à jour en mars 2023, recommandent désormais de ne plus utiliser de facteurs de correction raciale dans les calculs de la fonction rénale (comme la formule eGFR). Pourquoi ? Parce que les estimations basées sur la race sont inexactes et masquent les véritables causes génétiques.
Le Dr Olugbenga Gbadegesin, de l’université Vanderbilt, l’a dit clairement : « Nous ne devons pas confondre la race - un concept social - avec l’ascendance génétique. »
Le gène APOL1 n’est pas un « problème noir ». C’est un problème de génétique ancestrale. Et traiter les inégalités rénales, c’est d’abord comprendre cette distinction.
Que réserve l’avenir ?
En 2023, le NIH a lancé une étude de 10 ans appelée APOL1 Observational Study, qui suit 5 000 personnes avec un génotype à haut risque. L’objectif ? Comprendre quels facteurs déclenchent vraiment la maladie, et comment la prévenir.
Si les traitements ciblés comme VX-147 réussissent, ils pourraient réduire les disparités dans les insuffisances rénales de 25 à 35 % d’ici 2035. Mais cela ne suffira pas si les tests ne sont pas accessibles à tous.
La science a trouvé une pièce manquante du puzzle. Maintenant, c’est à nous - médecins, patients, décideurs - de la placer au bon endroit.



Oumou Niakate
décembre 7, 2025 AT 11:07Je viens du Mali et j’ai jamais entendu parler de ce gène, mais ça fait sens. Ma tante a perdu ses reins à 48 ans, on croyait que c’était la pression…
Chanel Carpenter
décembre 9, 2025 AT 03:57C’est fou comment on peut penser que c’est une question de race alors que c’est juste de la génétique ancestrale. J’adore quand la science corrige les idées reçues. 😊
Sophie Burkhardt
décembre 9, 2025 AT 16:17Je pleure en lisant ça. J’ai une amie qui a attendu 5 ans avant qu’on fasse le test… Elle a perdu 60% de ses reins à cause d’un médecin qui a tout attribué à « l’hypertension noire ». C’est pas juste. C’est criminel. 💔
Juliette Chiapello
décembre 9, 2025 AT 16:23La molécule VX-147 est un vrai breakthru. La protéinurie en baisse de 37% en 13 semaines ? C’est du jamais-vu dans la néphrologie. 🧬💊
Patrice Lauzeral
décembre 10, 2025 AT 03:11Je me demande… si je suis d’ascendance africaine, mais que je vis en France depuis 4 générations, est-ce que ça compte toujours ? Je veux dire… je ne suis pas « africain »… je suis français. 😕
Jean-Thibaut Spaniol
décembre 11, 2025 AT 09:59Comme toujours, les Américains sont les premiers à faire des tests génétiques… tandis que chez nous, on attend que les gens meurent pour réagir. La France n’a pas de politique de dépistage préventif pour les maladies génétiques à pénétrance incomplète. C’est pathétique. On préfère les slogans à la science. 🤷♂️
Et puis, on parle de « race » comme si c’était un mot tabou, mais on continue d’utiliser des formules eGFR raciales dans les hôpitaux. Hypocrisie pure. Les médecins français sont aussi mal formés que les Américains, juste avec un accent plus fin.
Le gène APOL1 n’est pas un problème de « Noir », c’est un problème de génétique. Mais les politiques ne veulent pas entendre ça parce que ça dérange le récit identitaire. On préfère les mots doux aux vérités dures.
Je suis médecin, et je peux vous dire que 90 % des collègues ne savent pas ce qu’est un génotype à haut risque. Ils lisent les résultats comme s’ils étaient des horoscopes. Et ils envoient les patients chez le néphrologue… trop tard.
La solution ? Former les généralistes. Mettre le test dans les bilans de santé annuels pour les personnes d’ascendance subsaharienne. Et arrêter de penser que la médecine est une affaire de couleur de peau. C’est de la biologie, pas du théâtre.
Estelle Trotter
décembre 12, 2025 AT 03:24Comment ose-t-on parler de génétique alors qu’on nous dit que les Africains sont « inférieurs » ? C’est juste un nouveau prétexte pour dire qu’on est « plus malades » ! Je refuse ce discours ! 🇫🇷✊
Nicole Perry
décembre 12, 2025 AT 16:04La vie est une équation… APOL1 = hérédité x environnement. Le corps est un temple, mais le temple est construit sur des fondations ancestrales… et parfois, les pierres s’effondrent. On ne choisit pas ses gènes… mais on peut choisir de les écouter. 🌱
cristian pinon
décembre 13, 2025 AT 09:01En tant que chercheur en génétique médicale, je tiens à souligner que la notion de « pénétrance incomplète » dans le contexte de l’APOL1 représente un paradigme fondamental pour la médecine personnalisée. Les facteurs environnementaux modulateurs - notamment l’infection virale, l’hypertension systémique non contrôlée, et les expositions toxiques médicamenteuses - agissent comme des triggers épigénétiques, activant des voies de stress rénal via la voie de l’apoptose mitochondriale. L’absence de traitement ciblé actuel ne doit pas être interprétée comme une stagnation scientifique, mais comme une fenêtre d’opportunité pour la recherche translationnelle. La cohorte APOL1 Observational Study du NIH, avec ses 5 000 sujets suivis sur 10 ans, constitue un modèle de recherche longitudinale sans équivalent dans l’histoire de la néphrologie. Il est impératif que les systèmes de santé européens, notamment français, intègrent ce modèle de dépistage préventif dans les protocoles de soins primaires, en collaboration avec les communautés diasporiques, afin de réduire les disparités de santé qui résultent non pas d’un déterminisme biologique, mais d’un déterminisme institutionnel.